LA ELECTRONEGATIVIDAD :
De un elemento es la capacidad que tiene un átomo de dicho elemento para atraer hacia sí los electrones, cuando forma parte de un compuesto. Si un átomo tiene una gran tendencia a atraer electrones se dice que es muy electronegativo (como los elementos próximos al flúor) y si su tendencia es a perder esos electrones se dice que es muy electropositivo (como los elementos alcalinos). La electronegatividad tiene numerosas aplicaciones tanto en las energías de enlaces, como en las predicciones de la polaridad de los enlaces y las moléculas y, también, en la racionalización de los tipos de reacciones que pueden experimentar las especies químicas.
Por el concepto que supone, la electronegatividad se ha definido de varias formas, y aún hoy es objeto de debate. La definición original de electronegatividad de Pauling está relacionada con la energía puesta en juego cuando se forman enlaces químicos. Supóngase un enlace covalente A-B, con la energía del enlace EAB. Conociendo las energías de los enlaces A-A y B-B, se puede calcular el parámetro D como sigue:
Δ = EAB – ½ (EAA + EBB)
Este parámetro da una idea acerca de la desviación que el enlace A-B pueda tener desde una situación de enlace covalente puro. Cuanto mayor sea D, mayor será la contribución iónica a ese enlace, y en ese sentido aumenta la diferencia de electronegatividad entre ambos elementos A y B.
La definición de electronegatividad de Pauling viene dada por la siguiente expresión:
| χA - χB | = 0.102 x √Δ
Δ (kJ/mol)
La figura que se encuentra debajo muestra la variación de la electronegatividad de Pauling con respecto al número atómico, apreciándose una evolución similar a la ya observada en el radio iónico o en la energía de ionización.
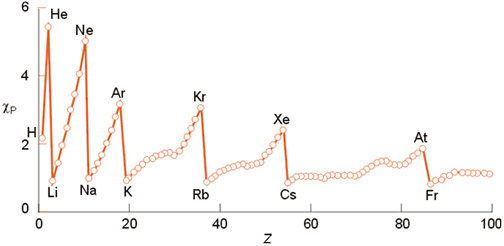
Variación de la electronegatividad (escala de Pauling) con el número atómico.
La escala de Pauling presenta algunas limitaciones, pues por ejemplo dependen del número de oxidación del elemento (la figura corresponde a los valores del máximo estado de oxidación de cada elemento). Sin embargo, esta escala es muy adecuada para calcular energías de enlace entre elementos de diferente electronegatividad así como para una visualización cualitativa de la polaridad de los enlaces.
Otra definición de esta propiedad atómica fue propuesta por Robert Mulliken al observar que cuando un elemento presenta una elevada energía de ionización, I, y una elevada afinidad electrónica, Ae, entonces presenta una gran tendencia a adquirir electrones más que a perderlos. Por ello, cuando ese elemento forme parte de un compuesto químico deberá ser bastante electronegativo. Por el contrario, cuando tanto la energía de ionización, I, como la afinidad electrónica, Ae, de un elemento tengan valores bajos, dicho elemento tendrá una marcada tendencia a perder los electrones cuando forme parte de un compuesto y, en consecuencia, será clasificado como elemento electropositivo. Estas observaciones llevaron a Mulliken a proponer su propia definición de la electronegatividad conocida como electronegatividad de Mulliken, cM, que se define como el valor medio de la suma de la energía de ionización y la afinidad electrónica de un átomo:
χM= ½ (I+Ae)
Si tanto I como Ae son elevados entonces cM tendrá también un valor alto; por el contrario si I y Ae son bajos entonces cM tendrá un valor pequeño.
Las escalas de electronegatividad de Pauling y Mulliken se pueden relacionar entre sí mediante la siguiente expresión:
χP = 1,35(√χM) -1,37
Una tercera escala de electronegatividad fue propuesta por Allred y Rochow, sobre la base de que esta propiedad viene determinada por el campo eléctrico sobre la superficie del átomo. El campo eléctrico para un sistema de este tipo debe ser proporcional a Zef/r2, lo que explica la forma de esta definición:
χAR = 0.744 + (0.3590 Zef/ r2)
donde r se expresa en Å. Las constantes numéricas se han elegido para obtener valores de electronegatividad del mismo rango que las otras escalas comentadas.
ESTRUCTURA DE LEWIS:
ESTRUCTURA DE LEWIS
El enlace de los elementos representativos se enfoca principalmente en los electrones de valencia, que son las subcapas s y p externas. El químico norteamericano Gilbert N. Lewis propuso representar los electrones de valencia por cruces o puntos a fin de visualizar cómo se transfieren o comparten los electrones en un enlace químico cuando los átomos se unen. Éstos se colocan alrededor del símbolo del elemento. Dado que el enlace de estos elementos entraña el acceso a ocho electrones (cuatro pares), los electrones se representan mediante uno o dos puntos en los cuatro lados del símbolo del elemento. Aunque los electrones de valencia provienen de dos diferentes subcapas (s y p), sólo el número total de estos electrones, es importante para cuestiones de enlace. Así primero es conveniente colocar un electrón en cada lado del símbolo (grupos IA a IVA), y después representar pares de electrones (grupo VA a 0).
Se recomienda seguir los siguientes pasos:
1. Se escribe el símbolo del elemento, que representa el núcleo y todos los electrones excepto aquellos en su último nivel o capa de valencia.
2. Se escribe la configuración electronica del elemento. Se seleccionan los electrones que están en el último nivel energético.
3. Cada "lado" (arriba, abajo, a la izquierda, a la derecha) del símbolo representa un orbital. Es importante recordad qué electrones están pareados y cuáles no lo están. No es importante qué lado representa a qué orbital.
ENLACE QUÍMICO:
Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatónicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la electrodinámica cuántica. Sin embargo, en la práctica, los químicos suelen apoyarse en la mecánica cuántica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su propia descripción del enlace químico. En general, el enlace químico fuerte está asociado con la compartimento o transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatónicos -o sea la mayor parte del ambiente físico que nos rodea- está unido por enlaces químicos, que determinan la estructura de la materia. Teniendo en cuenta que las cargas opuestas se atraen,porque, al estar unidos, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
En la visión simplificada del denominado enlace covalente, uno o más electrones (frecuentemente un par de electrones) son llevados al espacio entre los dos núcleos atómicos. Ahí, los electrones negativamente cargados son atraídos a las cargas positivas de ambos núcleos, en vez de sólo su propio núcleo. Esto vence a la repulsión entre los dos núcleos positivamente cargados de los dos átomos, y esta atracción tan grande mantiene a los dos núcleos en una configuración de equilibrio relativamente fija, aunque aún vibrarán en la posición de equilibrio. En resumen, el enlace covalente involucra la compartición de electrones en los que los núcleos positivamente cargados de dos o más átomos atraen simultáneamente a los electrones negativamente cargados que están siendo compartidos. En un enlace covalente polar, uno o más electrones son compartidos inequitativamente entre dos núcleos.
En una visión simplificada de un enlace iónico, el electrón de enlace no es compartido, sino que es transferido. En este tipo de enlace, el orbital atómico más externo de un átomo tiene un lugar libre que permite la adición de uno o más electrones. Estos electrones recientemente agregados ocupan potencialmente un estado de menor energía (más cerca al núcleo debido a la alta carga nuclear efectiva) de lo que experimentan en un tipo diferente de átomo. En consecuencia, un núcleo ofrece una posición de más fuerte unión a un electrón de lo que lo hace el otro núcleo. Esta transferencia ocasiona que un átomo asuma una carga neta positiva, y que el otro asuma una carga neta negativa. Entonces, el enlace resulta de la atracción electrostática entre los átomos, y los átomos se constituyen en ((iones)) de carga positiva o negativa.
ENLACE COVALENTE:
Cuando el par de electrones que forma el enlace covalente es donado por uno solo de los átomos se denomina enlace covalente coordinado. Una vez formado este enlace no se puede distinguir del resto de los enlaces covalente que forman la molécula.
En los enlaces covalentes descritos, los electrones del enlace compartidos son proporcionados uno por cada uno de los átomos enlazados. En algunos casos los electrones del par compartido son donados por uno solo de los átomos enlazados. Este tipo de unión se llama enlace covalente coordinado. El uso de este modelo, es únicamente para ayudar a comprender que existen matices dentro del enlace covalente.
Este enlace también se llama dativo y en él átomo no metálico comparte un par de electrones con otro átomo, pero el segundo los acomoda en un orbital vacío. Se dice entonces que el primer átomo da un par de electrones o que ambos átomos se coordinan para completar su octeto.
Características del enlace covalente no polar:
· Moléculas verdaderas diatómicas (con dos átomos)
· Actividad química media.
· Baja solubilidad en agua.
· No conducen el calor o la electricidad.
· Estado físico gaseoso, aunque pueden existir como sólidos o líquidos.
Son sustancias gaseosas o muy volátiles, como H2,O2, Cl2. Algunos presentan puntos de fusión enormemente elevados. Son cuerpos muy duros. Insolubles en casi todos los disolventes.
Características del enlace covalente polar:
· Moléculas que existen en los tres estados físicos de agregación de la masa.
· Gran actividad química.
· Solubles en disolventes polares.
· En solución acuosa son conductores de la electricidad.
· Sus puntos de fusión y ebullición son bajos, pero más altos que los de las sustancias no polares.
· Presentan puntos de fusión y ebullición bajos, pero mayores que los de las sustancias formadas por moléculas no polares de magnitud parecida. Son solubles en líquidos polares.
ENLACE IONICO:
La definición química de un enlace iónico es: una unión de moléculas que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta, unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua; si la atracción es menor, como en el caso del NaCl, el punto de fusión también es menor y, en general, son solubles en agua e insolubles en líquidos apolares como el benceno.

No hay comentarios:
Publicar un comentario